
Развитие современной науки и прикладных ее направлений осуществляется во всех отраслях человеческой деятельности. Новейшие технологии всё чаще находят применение даже в одной из наиболее консервативных отраслей сельского хозяйства – животноводстве. Внедрение научных технологических разработок дает ощутимые результаты на таких этапах как кормление животных, кормопроизводство, содержание поголовья, скоростное выращивание мясного молодняка и т. п. Кроме того, более весомое значение приобретает генная инженерия. Умение искусственно изменять набор генов животных открывает огромные перспективы перед учёными, животноводами и человечеством в целом.
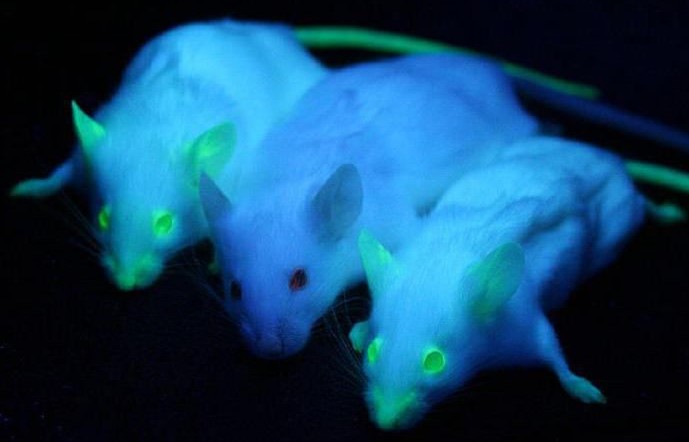
Когда речь заходит о трансгенных животных, воображение большинства из нас создает некий фантастический образ свирепого существа-конструктора, в котором соединены воедино части тел разных животных. А учёных, занятых трансгенной работой, многие представляют как злых гениев, ведущих цивилизацию к неминуемой гибели. Но на практике всё совсем иначе. И хотя некоторые трансгенные животные, созданные ради эксперимента (например, светящиеся в темноте мыши) внешне отличаются от обычных, в большинстве своём они сохраняют прежний облик.
Главными критериями в создании трансгенных особей являются их качественные и количественные показатели продуктивности, а не внешние признаки. Генетически модифицированные животные создаются преимущественно не для развлечения, а для рационального решения глобальных проблем, связанных с дальнейшим существованием человечества.
Основные цели вмешательства в генетическую суть живых организмов состоят в изменение свойств животных в нужном для человека направлении, приобретении ими новых возможностей, а также в устранении некоторых негативных качеств. С помощью генной инженерии учёные создают животных с особыми, необычными параметрами продукции, животных, устойчивых к различным болезням, животных с повышенной продуктивностью и т. д. Благодаря такой работе можно уверенно утверждать, что на сегодняшний день в животноводстве уже достигнуты большие успехи.
Так, например, были созданы и уже успешно используются овцы с вполне обычной внешностью, которые вырабатывают молоко, содержащее фермент химозин. В молокоперерабатывающей отрасли он очень важен для производства твёрдых сыров. Раньше его получали только из сычуга (части многокамерного желудка) новорождённых жвачных животных: телят, ягнят, козлят. Для этого молодняк забивали в первые дни их жизни.
Теперь же одна трансгенная овца за лактационный период (несколько месяцев) вырабатывает такое количество химозина, которого достаточно для производства тридцати тонн твёрдого сыра! Поголовье генномодифицированных, «химозиновых» овец насчитывает сегодня целое стадо! И можно только представить, сколько новорождённого молодняка жвачных животных было сохранено с помощью этого достижения генной инженерии.

Если говорить о теме сыра и трансгенных животных, то в Англии существует большое стадо генномодифицированных коров, продуцирующих молоко с идеальным составом для производства сыра «Чеддер», который так высоко ценится в мире. Ещё созданы коровы, в молоке которых значительно снижено содержание веществ, способных вызвать аллергические реакции у потребителей. При этом количество кальция и некоторых витаминов в нём – повышенное.

Уже получены трансгенные рыбы нескольких видов, в генетический код которых добавлен ген, кодирующий повышенный синтез соматотрофного гормона (гормона роста), благодаря чему рыба растёт быстрее и вырастает крупнее своих обычных размеров. Примером может служить атлантический лосось фирмы «AquaBounty», который развивается в два раза быстрее обычного.
Для достижения такого эффекта обычному лососю был внедрён участок гена угреобразной рыбы американская бельдюга, который увеличивает продуцирование соматотрофного гормона в организме лосося, причём независимо от температуры воды. Мясо нового лосося ничем не отличается от остальных представителей этого вида, но при этом время выращивания товарной рыбы сокращается вдвое!
В другом примере переноса генов результаты ещё более впечатляют. В результате введения в ядра оплодотворённых икринок рыбы нерка генетической информации, кодирующей повышенную выработку гормона роста, годовалые трансгенные нерки, которые вывелись из этих икринок, весили в среднем в 10 раз больше, чем их нетрансгенные ровесники!

С помощью генной инженерии созданы также свиньи, у которых добавлен геном, кодирующий выработку пищеварительного фермента фитазы. Эти животные лучше переваривают и усваивают корм, благодаря чему повышается его конверсия и ускоряется рост свиней. В результате, при тех же затратах корма существенно повышается продуктивность животных, и мяса производится значительно больше.
Создание сельскохозяйственных животных, устойчивых к основным заболеваниям, которые наносят ощутимый материальный ущерб хозяйству и даже могут передаваться человеку, имеет большие экономические перспективы, т. к. это поможет избежать расходов на профилактику, лечение, устранение последствий заболеваний (дезинфекция, утилизация павших животных, карантинные ограничения и пр.), а также недополучения продукции.
Например, ведутся исследования по решению проблемы лейкоза крупного рогатого скота, который вызывают РНК-содержащие вирусы. Введение в ядро генов, кодирующих антисмысловую РНК, теоретически должно сделать КРС устойчивым к лейкозу. Эксперименты на кроликах уже дали положительный результат. Одно из подобных достижений – свиньи, поросята которых резистентны к диарее, что очень упрощает их выращивание.
Уже сейчас существуют коровы с генами зебу, которые отличаются невосприимчивостью ко многим кровепаразитарным заболеваниям. Введенные в геном крупного рогатого скота гены зебу кодируют сразу несколько признаков, благодаря чему полученные трансгенные животные вместе с устойчивостью к болезням приобрели повышенную жаровыносливость и неприхотливость к кормовой базе.

Но генные модификации можно применять не только для решения продовольственных и экономических задач. Используя генную инженерию, можно удовлетворять многие человеческие потребности в педиатрии и медицине в целом. Одна из групп генномодифицированных коров способна давать молоко, содержащее человеческий белок лактоферрин (в молоке обычных коров этого вещества нет). Лактоферрин является важной составляющей гуморального иммунитета, он обладает противовирусным, антибактериальным, противогрибковым, антипаразитарным действием, а также каталитической активностью и используется при искусственном выкармливании новорождённых детей.
Также ведётся работа по созданию свиней, способных продуцировать интерферон человека, в котором очень нуждается фармацевтическая отрасль. От модифицированных животных (коров, свиней, коз, кроликов, овец) уже удалось получить восемнадцать лекарственных белков. В качестве живых биологических фабрик они существенно рентабельнее, чем аналогичное по производительности промышленное производство нужных веществ.
В Англии учёные-генетики смогли создать трансгенных кур, которые несут яйца, содержащие лечебный белок с miR24-молекулой и человеческий интерферон b-1a. После специальной обработки эти вещества используются как сырьё в производстве препаратов, предназначенных для лечения артритов, множественного рассеянного склероза и злокачественных опухолей у человека.
Но как же создают трансгенных животных? Процесс этот очень длительный и непростой. Существует несколько основных способов создания генных модификаций у высших животных:
– пронуклеарная микроинъекция;
– использование вирусных конструкций;
– использование эмбриональных стволовых клеток.
Из них наиболее удобный и часто используемый – это метод пронуклеарной микроинъекции. Его преимущества состоят в том, что он универсален: с его помощью можно вмешиваться в геном любых животных. Этот метод позволяет получить быстрый результат: требуемые показатели проявляются уже в первом поколении. Он не имеет ограничений по размеру внедряемого участка ДНК. Если при использовании вирусных конструкций можно вставить только 8–10 тысяч пар нуклеотидов, то с помощью пронуклеарной микроинъекции можно ввести во много раз больше – 100 тысяч и даже несколько миллионов пар нуклеотидов! Т. е. за одно вмешательство можно ввести намного больше целевой генетической информации.
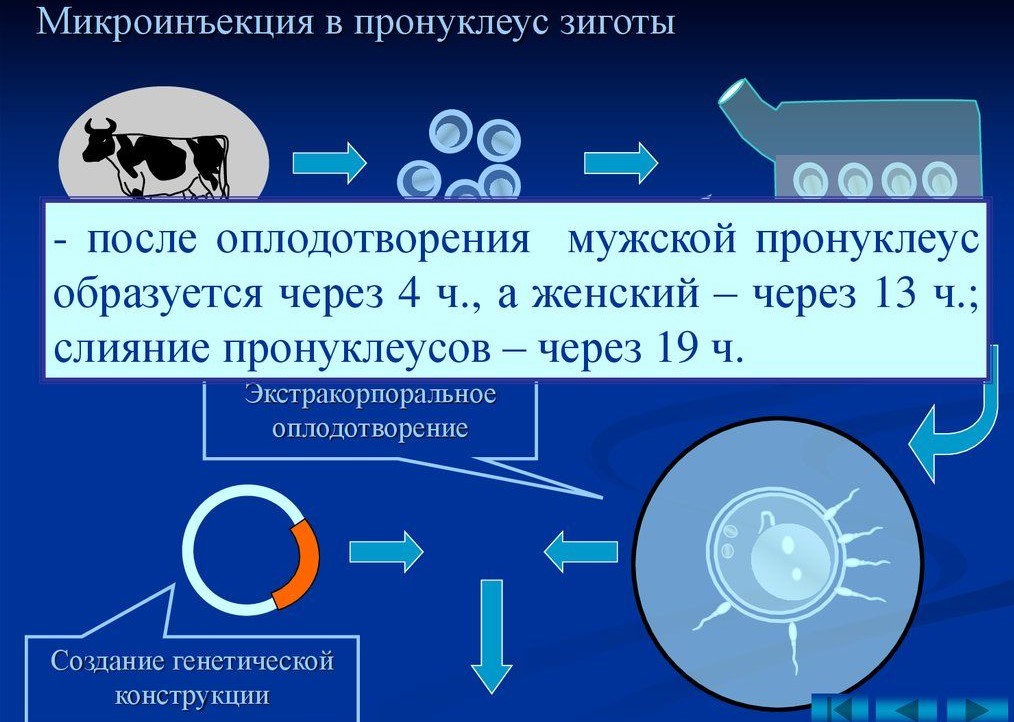
Суть этого способа следующая: у отобранных самок животных искусственно стимулируют овуляцию и оплодотворяют вышедшие яйцеклетки. Затем, либо в ядро мужского пронуклеуса, либо в ядро создавшейся клетки на стадии зиготы внедряют с помощью специального оборудования (микроманипулятора) нужный участок ДНК (или генную конструкцию).
После внедрения зиготу неделю (за это время целевой ген встраивается в геном клетки-рецепиента и изменённая клетка начинает своё развитие в многоклеточный модифицированный организм) культивируют в питательной среде с высоким содержанием углекислого газа (5%, как в живых тканях организма млекопитающих), затем на стадии морулы или ранней бластоцисты пересаживают в матку суррогатной матери.
Крупным животным – коровам, кобылам, верблюдицам – пересаживают по две зиготы, козам и овцам по 3–4, свиньям и крольчихам по 20–30. После рождения приплод проверяют на присутствие нужной генетической информации и, в случае положительного результата, разводят «в себе» как основу будущей трансгенной популяции, используя отбор и подбор, как и в обычной племенной работе. Молодняк, рождённый от трансгенных животных, во всех дальнейших поколениях наследует его модифицированный набор генетической информации и связанные с этим свойства.
Достаточно хорошо отработаны технологии генных модификаций для таких видов рыб как форель, карп, лососевые. Они состоят в том, что нужные участки ДНК вводят в оплодотворенные икринки с помощью микроинъекции. Развитие модифицированной икры протекает в воде, в ванных с регулируемыми параметрами микроклимата.
После инъекций чужеродных генов выживает примерно от 35 до 80% эмбрионов. Из них успешно принимают новые гены в свой генетический набор от 10 до 70%. То есть, эффективность перенесения нужной наследственной информации у промысловых рыб относительно большая. Ведётся работа по внедрению генов, которые увеличат устойчивость рыбы к болезням и неблагоприятным воздействиям окружающей среды.
Далеко не все попытки генных манипуляций заканчиваются успешно. На каждом этапе количество эмбрионов постоянно уменьшается на 10–20% по разным причинам. Какие-то гибнут, других отбраковывают сами учёные. Из тысячи яйцеклеток может получиться лишь несколько удачных трансгенных животных.
Технология микроинъекции даёт хорошие по качеству результаты, но она слишком дорогая. Создание одной минимальной популяции из нескольких трансгенных животных стоит от 60 до 300 тысяч долларов США. Кроме того, для осуществления необходимых действий нужен микроманипулятор и другое дорогостоящее оборудование. Намного дешевле создавать трансгенных животных с помощью вирусов.
Для осуществления этого способа учёные сначала создают псевдовирус из обычного вируса. Суть преобразования состоит в том, что из вируса удаляют большинство его генов, оставляя только самые необходимые для его выживания, и прикрепляют нужный для создания трансгенного животного участок ДНК. После этого измененным, относительно безвредным вирусом обрабатывают зиготу.
Вирус проникает в зиготу, самостоятельно встраивается в геном зиготы и одновременно встраивает нужный ген. Затем зиготу культивируют некоторое время в инкубаторе и трансплантируют в матку суррогатной матери, а по истечении срока беременности получают трансгенный молодняк. Это потомство тестируют на присутствие того гена, который планировалось ввести в его геном, отбирают нужных особей и размножают их с применением жёсткой выбраковки животных, не соответствующих заданным параметрам, искусственного отбора и подбора пар, как и в предыдущем случае.
Эффективность этого метода намного выше, чем микроинъекции – она составляет до 70%! Но есть и недостатки: не только чужой ген действует на геном эмбриона, но и сам геном влияет на чужеродный ген, изменяя его работу. Если вирус встроился в участок ДНК эмбриона, который активно не работает, то и этот целевой ген тоже работать не будет, несмотря не своё присутствие в геноме трансгенного животного. Впервые вирусы для переноса гена использовал Рудольф Яниш в 1970 году.
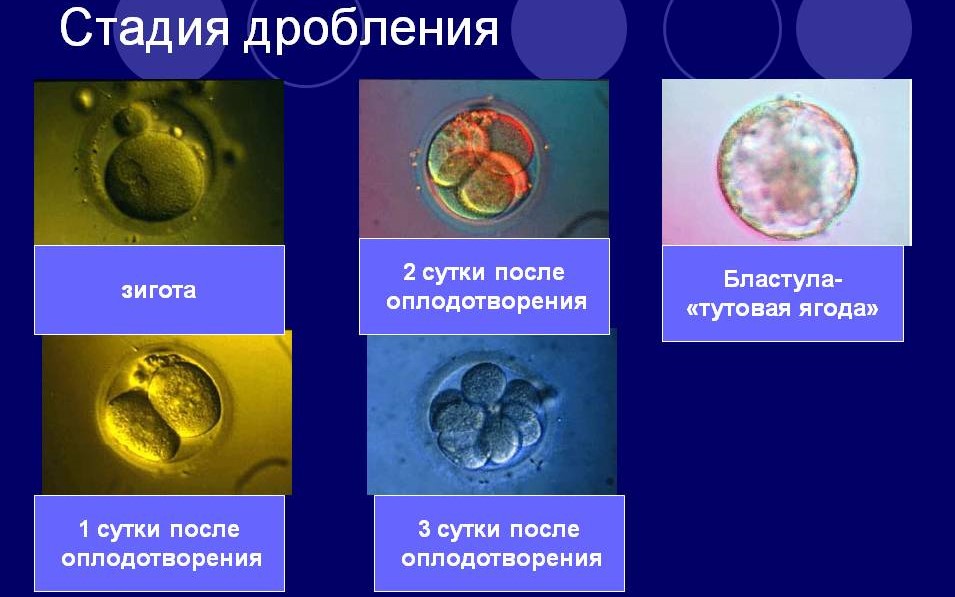
Метод создания трансгенных организмов с применением эмбриональных стволовых клеток практикуют, в основном, в научных исследованиях, а не для модификации продуктивных сельскохозяйственных животных. Если коротко описать процесс, то упрощённо он выглядит так: сначала получают из клеточной массы бластоцисты мыши эмбриональные стволовые клетки. Затем их генетически модифицируют, внося нужный ген, после чего культивируют в питательной среде с 5%-ным содержанием углекислого газа и вводят в предварительно полученные зиготы на стадии бластоцисты. «Откорректированные» зиготы помещают в матки суррогатных матерей. Полученное потомство учёные проверяют на присутствие целевого гена, и отобранных трансгенных животных спаривают между собой, создавая таким образом целую трансгенную популяцию для научных исследований.
Если в ходе ознакомления с данным материалом у вас возникли вопросы, их можно задать на нашем форуме.
Виталий Чугуевец
Поділитись в соцмережах:


